肖俊宇课题组阐明免疫球蛋白IgM被特异性受体FcμR识别的分子机制
蛋白质与植物基因研究国家重点实验室、北京大学生命科学学院、北大清华生命科学联合中心肖俊宇研究员课题组通过结构生物学、生物化学和细胞生物学等手段揭示了FcμR特异性感知不同形式IgM的分子机制,为深入理解IgM的生物学功能奠定了基础。
IgM是人体内五类免疫球蛋白之一,主要由脾脏和淋巴结中浆细胞分泌合成,具有强大的杀菌、激活补体、免疫调理和凝集作用,在免疫应答早期阶段发挥重要功能。FcμR(也称为Toso或Faim3)是哺乳动物中唯一的IgM特异性受体,它可以与不同形式的IgM(包括膜结合型IgM单体、血清中的IgM五聚体和六聚体以及分泌型IgM)结合,从而参与B细胞发育、免疫系统稳态调控和抗原呈递等过程。在慢性淋巴细胞白血病患者中,B细胞表面FcμR的高表达也体现了其在免疫系统和疾病发生中的重要性。但在过去,FcμR发挥功能的分子机制尚不明确。
肖俊宇课题组的最新成果《FcμR受体对免疫球蛋白IgM的识别》(“Immunoglobulin Mperception by FcμR”)于3月22日在线发表于Nature,揭示了FcμR识别不同形式IgM的分子机制。这是继2020年肖俊宇课题组在Science杂志发表论文阐明IgM五聚体组装和黏膜转运的分子机制之后的又一重大突破。
为了探究FcμR对不同形式IgM的识别机制,该研究首先重组表达了FcμR-D1结构域和IgM-Cμ4结构域的复合体,并解析了其晶体结构。接着,该研究进一步利用冷冻电镜技术解析了IgM五聚体核心区和FcμR胞外域组成的复合体结构。进一步地,该研究利用冷冻电镜技术解析了FcμR与分泌型IgM核心区形成的复合物结构。
为了评估上述研究的功能相关性,该研究又设计了FcμR突变体,并通过体外蛋白互作、荧光共聚焦显微镜、流式细胞术等手段对上述结果进行了验证。总之,该研究通过结构生物学、生物化学和细胞生物学等手段揭示了FcμR特异性感知不同形式IgM的分子机制,为深入理解IgM的生物学功能奠定了基础。

研究成果Nature截图
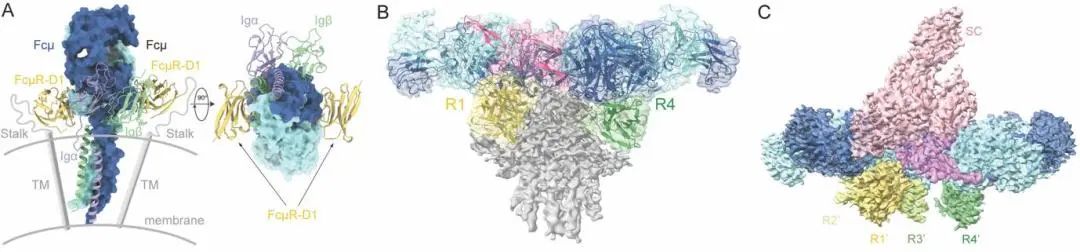
FcμR受体对膜结合型 IgM、IgM五聚体和分泌型IgM的识别模型
肖俊宇为该论文的通讯作者。北京大学已出站博士后李雅鑫、生命科学学院2019级博士生沈皓、前沿交叉学科研究院2019级博士生张瑞雪为该论文的共同第一作者。本研究还得到了北京大学生命科学学院启东产业创新基金、昌平实验室、中国博士后科学基金(博新计划)、北京大学博雅博士后项目的支持。
来源:北京大学